Фармакотерапия болей в спине
Захаров В.В.
Докт. мед. наук, доц. кафедры нервных болезней ММА им. И.М. Сеченова
Боль в пояснице и шее является одной из наиболее частых причин обращения к врачу. Распространенность среди населения болевых синдромов, связанных с заболеваниями позвоночника, чрезвычайна высока. Не будет преувеличением сказать, что каждый человек хотя бы однажды в жизни испытывал боль в спине. По статистике, данная патология является второй по частоте причиной временной утраты трудоспособности среди лиц молодого и среднего возраста после ОРВИ.Об этиологии и патогенетических особенностях, клинических проявлениях и принципах фармакотерапии синдрома острой боли в спине рассказывает доц. кафедры нервных болезней ММА им. И.М. Сеченова, докт. мед. наук Владимир Владимирович ЗАХАРОВ.
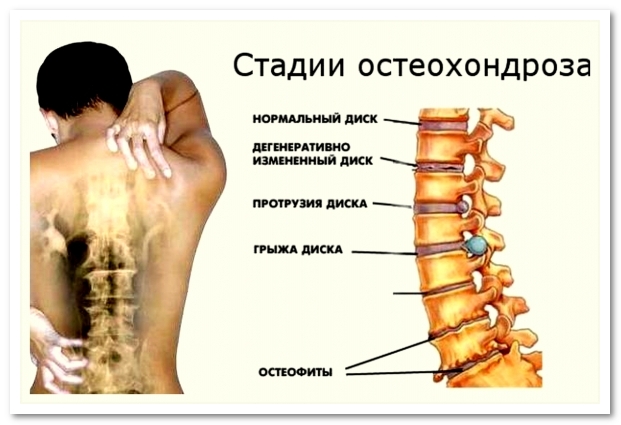
Распространено мнение, что причиной боли в спине является остеохондроз позвоночника. Это не совсем точно. Остеохондроз представляет собой дегенеративные изменения в межпозвонковых дисках, которые с возрастом развиваются у подавляющего большинства людей. Сами по себе данные изменения клинической симптоматикой не сопровождаются. Однако при наличии явлений остеохондроза чаще возникают такие осложнения, как разрыв фиброзного кольца и формирование грыжевого выпячивания межпозвонкового диска в просвет позвоночного канала. Это может приводить к раздражению нервных окончаний в связках позвоночника или к сдавлению спинно-мозговых корешков. Таким образом, остеохондроз позвоночника можно назвать фактором риска возникновения болевых синдромов, но не их непосредственной причиной.
Остеохондроз не является единственным видом дегенеративных изменений позвоночника. Не менее часто с возрастом образуются дополнительные костные разрастания (спондилез), отмечаются изменения межпозвонковых суставов (спондилоартроз), уменьшение концентрации кальция в позвонках (остеопороз) и т.д. Все вышеперечисленные процессы являются неблагоприятным морфологическим фоном, предрасполагающим к развитию целого ряда осложнений. В то же время само по себе наличие дегенеративных изменений позвоночника еще не означает неизбежности боли, а уменьшение боли в процессе лечения никак не связано с регрессом морфологических изменений.
Клинически различают два вида болей в спине: корешковые и скелетно-мышечные. Корешковые боли связаны со сдавлением спинно-мозговых корешков. Причиной их компрессии обычно является грыжевое выпячивание межпозвонкового диска в просвет позвоночного канала или дополнительные костные разрастания (остеофиты). Корешковые боли всегда сильные, отдают в ногу или в руку (в зависимости от локализации компрессии), носят стреляющий или дергающий характер, весьма типичным также является ощущение прохождения электрического тока от позвоночника в пострадавшую конечность. Как правило, боли при сдавлении корешка сопровождаются неврологическими симптомами: нарушением чувствительности, мышечной слабостью, снижением сухожильных рефлексов. По статистике, компрессия спинно-мозговых корешков отмечается лишь в 5—10% случаев болевых синдромов на шейном и поясничном уровне.
Скелетно-мышечные боли отмечаются значительно чаще корешковых. Причиной скелетно-мышечной боли могут быть подвывихи межпозвонковых суставов, растяжение связок позвоночника, рефлекторные мышечные спазмы. Боли скелетно-мышечного происхождения могут быть разными по выраженности, обычно носят тупой или ноющий характер, провоцируются неловким движением, длительной неудобной позой, иногда переохлаждением или нервным потрясением. Боли скелетно-мышечного происхождения, как правило, местные, т.е. не иррадиируют в конечность. При этом очаговой неврологической симптоматики не определяется.
Лечение заболеваний позвоночника индивидуально и зависит от конкретной причины болевого синдрома, его выраженности и характера. Однако во всех случаях во время обострения одной из первоочередных задач врача является попытка минимизировать болевые ощущения. Помимо облегчения страданий пациента, эффективная симптоматическая терапия способствует также уменьшению риска трансформации острой боли в хроническую.
При выраженной боли в первые дни обострения показан постельный режим; далее рекомендуют носить фиксирующий пояс (или воротник, в зависимости от локализации патологического процесса). Местно применяются тепло, мази с раздражающим или противовоспалительным действием, проводятся отвлекающие мероприятия.
Медикаментозная терапия должна быть направлена как на периферические механизмы боли, так и на рецепцию болевых ощущений на уровне центральной нервной системы.
Для воздействия на центральные механизмы формирования боли в острой ситуации наиболее целесообразно назначение бензодиазепинов (Сибазон, клоназепам, алпрозалам и др.). Помимо центрального антиноцицептивного и анксиолитического действия, указанные препараты способствуют также мышечному расслаблению. Данный эффект наиболее выражен у Сибазона и имеет терапевтическое значение при боли, связанной с рефлекторным мышечным напряжением. В этих случаях может быть целесообразно также назначение таких миорелаксантов, как тизанидин, Мидокалм и баклофен.
В комплексную терапию боли, связанной с компрессией спинно-мозговых корешков, нередко включают противосудорожные препараты. Анальгетическое действие антиконвульсантов также связано с вмешательством данных препаратов в центральные механизмы формирования боли. К противосудорожным препаратам, применяемым при корешковых болях, относятся габапентин, карбамазепин, соли вальпроевой кислоты, ламотриджин, реже назначается фенитоин.
С целью воздействия на периферические механизмы боли широко используются нестероидные противовоспалительные препараты (НПВП). Анальгетический и противовоспалительный эффект препаратов данной фармакологической группы связан с ингибированием циклооксигеназы и уменьшением синтеза тканевых медиаторов воспаления. Для купирования боли, обусловленной заболеваниями позвоночника, в клинической вертеброневрологии широко применяются такие препараты из группы НПВП, как диклофенак, ибупрофен, индометацин, бутадион, пироксикам, лорноксикам, целекоксиб, нимесулид, напроксен, кетопрофен, декскетопрофен, и другие.
Важно отметить, что стойкий терапевтический эффект может быть достигнут лишь при целенаправленном воздействии на причину боли, которая в каждом конкретном случае индивидуальна. Поэтому лечение также должно быть индивидуальным и комплексным. При этом медикаментозная терапия должна сочетаться с физиотерапевтическим лечением, лечебной гимнастикой, методами мануальной медицины, местным введением анестетиков и противовоспалительных средств, иногда психотерапией и психофармакотерапией. В некоторых случаях может обсуждаться также необходимость и целесообразность нейрохирургического вмешательства.
Статья опубликована в журнале Фармацевтический вестник
Источник
Боль в спине является одной из частых причин нетрудоспособности, она значительно снижает качество жизни и остается одной из ведущих причин обращения за медицинской помощью. Боль в нижней части спины возникает значительно чаще, чем боль в шее или грудном отделе. Источниками боли в спине могут быть многочисленные анатомические структуры позвоночника, окружающие его ткани и внутренние органы. Такие эмоциональные расстройства, как тревога и депрессия, вносят большой вклад в развитие боли и ее хронизацию. Формирование хронической боли также зависит от особенностей развития личности, окружения больного, выбранной пациентом ментально-поведенческой стратегии преодоления боли. Чаще всего боль в спине имеет мышечное и спондилогенное происхождение, т.е. она связана с изменениями в мышцах спины, теле позвонков, межпозвонковом диске, суставах, связках. В случае развития конфликта между спинномозговым корешком и структурами позвоночника (чаще всего грыжевым выпячиванием межпозвонкового диска и остеофитом) развивается радикулопатия. Иногда причинами боли в спине могут стать патология внутренних органов грудной и брюшной полости, малого таза, а также психические расстройства.
Болевой синдром в области спины требует от врача дифференциально-диагностического подхода с корректной оценкой факторов риска и взвешенной терапевтической тактикой. Дифференциальная диагностика боли в спине предполагает исключение прогностически неблагоприятных и опасных состояний. Следует обращать внимание на наличие лихорадки, локальной болезненности и повышения местной температуры в паравертебральной области, которые характерны для инфекционного поражения позвоночника. Этот риск повышен у пациентов, получавших иммуносупрессивную терапию, в/в инфузии, страдающих ВИЧ-инфекцией. О наличии опухоли (первичной или метастатической) может свидетельствовать беспричинное снижение веса, злокачественное новообразование любой локализации в анамнезе, сохранение боли в покое и ночью, а также возраст пациента старше 50 лет. Компрессионный перелом позвоночника чаще отмечается в случаях травм, при применении кортикостероидов и у пациентов старше 50 лет.
Считается, что боль в спине часто имеет смешанный ноцицептивно-нейропатический характер, т.е. возникает вследствие активации болевых рецепторов (ноцицепторов) и повреждения невральных структур (например, корешков).
Ноцицептивная боль, как правило, острая, соответствует степени действия тканевого повреждения и длительности повреждающих факторов. Ноцицептивные болевые синдромы возникают в результате активации ноцицепторов при травме, воспалении, ишемии, чрезмерном растяжении тканей. Примерами являются боли при воспалении суставов позвоночника. В случае вовлечения в патологический процесс костной или мышечной ткани возникает ощущение тупой, ноющей боли. Эта боль усиливается при движении, ослабевает в покое и обычно хорошо локализована. При состоявшемся повреждении тканей возникает воспалительная реакция, одним из следствий которой является воспалительная боль. Макрофаги, тучные клетки и нейтрофилы выделяют многочисленные медиаторы воспаления. Последние воздействуют на ноцицепторы и повышают их чувствительность, в результате чего даже незначительное раздражение воспринимается как болевой сигнал. Хотя воспалительная боль является вариантом ноцицептивного типа боли, некоторые авторы выделяют ее как самостоятельную форму. Большинство специалистов рассматривают ее как вариант ноцицептивной боли, т.к. и при механическом, и термическом или химическом воздействии на ноцицепторы присутствуют те или иные элементы воспаления.
Другим частым патофизиологическим механизмом ноцицептивной боли является мышечный спазм. При боли в спине повышенная возбудимость ноцицепторов неминуемо вызывает рефлекторную активацию мотонейронов в соответствующих сегментах спинного мозга и сокращение мышц с последующим возбуждением мышечных ноцицепторов. Рефлекторное напряжение мышц вначале имеет защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако если ноцицептивная импульсация длительна, то такие мышцы сами становятся источником боли. Нейрогенное асептическое воспаление, возникающее при длительном напряжении мышц, способствует появлению участков болезненных мышечных уплотнений, которые еще больше усиливают афферентный поток ноцицептивных импульсов в структуры ЦНС. Все это приводит к сенситизации большого количества центральных ноцицептивных нейронов. Этот порочный круг играет важную роль в хронизации боли. Периферическое повреждение запускает целый каскад патофизиологических процессов, затрагивающих всю ноцицептивную систему от тканевых рецепторов до корковых нейронов, вызывая в них стойкие изменения возбудимости и развитие сенситизации, которые проявляются повышением болевой чувствительности, явлениями аллодинии. Выраженность и продолжительность периферической и центральной сенситизации при ноцицептивной боли напрямую зависят от характера и продолжительности повреждения тканей. Чем длительнее сохраняется повреждение, тем длительнее будет боль. Таким образом, эффективное купирование острой боли и устранение болезненного мышечного напряжения позволяют предупредить развитие хронической боли в спине.
Современная фармакотерапия острой боли в спине по своей сути представляет вынужденную полипрагмазию со всеми проблемами безопасности лечения, т.к. предполагает одновременное использование нестероидных противовоспалительных препаратов, неопиодных и опиодных анальгетиков, мышечных релаксантов центрального действия и ряда других препаратов.
Одним из возможных путей решения данной проблемы может стать применение лекарственного средства, обладающего сразу несколькими механизмами действия и влияющего на ряд звеньев патогенеза острой боли в спине. В настоящее время для лечения острого болевого синдрома за рубежом и в России широко применяется флупиртин (Катадолон® форте). Уникальность этого препарата в том, что он одновременно устраняет острую боль, мышечный спазм и препятствует развитию механизмов сенситизации в нейронах спинного мозга, что предотвращает переход острой боли в хроническую. Миорелаксирующий эффект флупиртина реализуется благодаря стимуляции ГАМК-рецепторов и блокированию передачи болевого импульса на мотонейроны и промежуточные нейроны спинного мозга, при этом мышечный тонус нормализуется в области боли, не вызывая генерализованной мышечной слабости. Анальгезирующее действие флупиртина обусловлено непрямым антагонизмом к NMDA-рецепторам. В терапевтических дозах препарат способствует открытию потенциалнезависимых калиевых каналов, что приводит к стабилизации мембранного потенциала нервной клетки. Установлено, что влияние на ток ионов калия опосредовано воздействием препарата на систему регуляторного G-белка. Это вызывает угнетение активности NMDA-рецепторов и, как следствие, блокаду нейрональных ионных каналов кальция, снижение внутриклеточного тока ионов кальция, угнетение возбуждения нейрона в ответ на ноцицептивные стимулы. В результате предупреждается формирование сенситизации и феномена «wind up» – увеличения нейронального ответа на повторные болевые стимулы. Это, в свою очередь, предотвращает усиление боли и переход ее в хроническую форму. Появление пролонгированной формы флупиртина – Катадолона Форте (400 мг) – расширяет возможности врача в проведении эффективной терапии острой неспецифической боли в спине.
Возникновение стреляющей, жгучей боли, иррадирующей в зону иннервации того или иного спинномозгового корешка или нерва и сопровождающейся объективно выявляемым изменением чувствительности, характерно для нейропатического болевого синдрома. Наиболее частыми причинами появления нейропатического компонента при боли в спине являются диско-радикулярный конфликт, стеноз позвоночного канала, спондилез. Нейропатический компонент боли выявляется у 10–19% пациентов с болью в спине [8–10]. Важную роль в формировании нейропатической боли играют изменения нейрофизиологических характеристик нервных волокон, нейронов спинномозговых ганглиев и задних рогов спинного мозга. Известно, что интенсивность боли не коррелирует со степенью протрузии диска или выраженностью компрессии корешка. Как правило, такие боли кроме иррадиации в конечности сопровождаются другими симптомами поражения корешков (снижение поверхностной и глубокой чувствительности, двигательные нарушения). Присутствие нейропатического компонента боли значительно усугубляет течение болевого синдрома в спине, способствует его хронизации и быстрой дезадаптации больных, нарушает качество их жизни, повышает расходы на лечение [10–12], способствует развитию инсомнии, тревоги, депрессии [13–15].
Для многих врачей лечение пациентов с хронической нейропатической болью остается сложной проблемой [16]. Одним из главных механизмов нейропатической боли является периферическая сенситизация, при которой особая роль принадлежит избыточной экспрессии и активности вольтаж-зависимых натриевых каналов на мембранах сенсорных периферических нейронов. В этом случае предпочтительнее назначить препараты, блокирующие эти каналы: пластины с лидокаином или антиконвульсанты (карбамазепин, окскарбазепин). Другим важным механизмом нейропатической боли является центральная сенситизация (гипервозбудимость центральных сенсорных нейронов), проявляющаяся аллодинией и вторичной гипералгезией. В этом случае патогенетически обоснованным является назначение средств, уменьшающих центральную сенситизацию: антиконвульсантов габапентина или прегабалина, которые связываются с α2δ-субъединицей кальциевых каналов и снижают частоту деполяризации ноцицептивных нейронов в заднем роге спинного мозга.
Результаты систематических обзоров свидетельствуют, что среди используемых для лечения нейропатической боли антидепрессантов, опиоидов и антиконвульсантов наиболее благоприятным соотношением эффективность/переносимость обладает прегабалин, что делает его в настоящее время препаратом первого выбора для лечения боли с нейропатическим компонентом [16]. В ряде клинических исследований прегабалин продемонстрировал не только высокую анальгетическую активность, но и эффективность в отношении сопутствующих аффективных расстройств и инсомнии у пациентов с периферической диабетической полиневропатией [23–26], постгерпетической невралгией [27–29], спинальной центральной нейропатической болью [30]. Принимая во внимание высокую коморбидность хронической нейропатической боли с тревогой и инсомнией, становится понятной важная роль прегабалина в лечении таких пациентов [16, 21, 45, 46].
Недавно на фармацевтическом рынке России появился новый европейский дженерик прегабалина – Альгерика®. Препарат рекомендован для лечения нейропатической боли в дозах от 150 до 600 мг/сут. Эффективным и безопасным представляется индивидуальный подбор дозы Альгерики методом постепенного увеличения суточной дозы на 75 мг каждые 7 дней.
Использование прегабалина в комплексном лечении больных с радикулопатией способствует более эффективному лечению этой патологии.
Литература
1. Verhaak P.F., Kerssens J.J., Dekker J. et al. Prevalence of chronic benign pain disorder among adults: a review of the literature // Pain. 1998. Vol. 77(3). P. 231–239. doi: 10.1016/S0304–3959(98)00117–1.
2. Lawrence R.C., Helmick C.G., Arnett F.C. et al. Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the United States // Arthritis. Rheum. 1998. Vol. 41(5). P. 778–799.
3. Bressler H.B., Keyes W.J., Rochon P.A., Badley E. The prevalence of low back pain in the elderly. A systematic review of the literature // Spine. 1999. Vol. 24(17). P. 1813–1819.
4. Elliott A.M., Smith B.H., Penny K.I. et al. The epidemiology of chronic pain in the community // Lancet. 1999. Vol. 354(9186). P. 1248–1252.
5. Donk J., Schouten J.S.A.G., Passchier J. et al. The association of neck pain with radiological abnormalities of the cervical spine and personality traits in a general population // J. Rheumatol. 1991. Vol. 18. P. 1884–1889.
6. Cote P., Cassidy J.D., Carroll L. The Saskatchewan Health and Back Pain Survey. The prevalence of neck pain and related disability in Saskatchewan adult // Spine. 1998. Vol. 23(15). P. 1689–1698.
7. Webb R., Brammah T., Lunt M. et al. Prevalence and predictors of intense, chronic, and disabling neck and back pain in the UK general population // Spine. 2003. Vol. 28(11). P. 1195–1202.
8. Carey T.S., Evans A.T., Hadler N.M. et al. Acute severe low back pain. A population-based study of prevalence and care-seeking // Spine. 1996. Vol. 21(3). P. 339–344.
9. Loney P.L., Stratford P.W. The prevalence of low back pain in adults: a methodological review of the literature // Phys. Ther. 1999. Vol. 79(4). P. 384–396.
10. Berger A., Dukes E.M., Oster G. Clinical characteristics and economic costs of patients with painful neuropathic disorders // J. Pain. 2004. Vol. 5(3). P. 143–149.
11. McDermott A.M., Toelle T.R., Rowbotham D.J. et al. The burden of neuropathic pain: results from a cross-sectional survey // Eur. J. Pain. 2006. Vol. 10(2). P. 127–135.
12. Lachaine J., Gordon A., Choiniere M. et al. Painful neuropathic disorders: an analysis of the Regie de l’Assurance Maladie du Quebec database // Pain Res. Manag. 2007. Vol. 12(1). P. 31–37.
13. Smith M.T., Haythornthwaite J.A. How do sleep disturbance and chronic pain inter-relate? Insights from the longitudinal and cognitive-behavioral clinical trials literature // Sleep. Med. Rev. 2004. Vol. 8(2). P. 119–132.
14. Rush A.J., Polatin P., Gatchel R.J. Depression and chronic low back pain: establishing priorities in treatment // Spine. 2000. Vol. 25(20). P. 2566–2571.
15. McWilliams L.A., Goodwin R.D., Cox B.J. Depression and anxiety associated with three pain conditions: results from a nationally representative sample // Pain. 2004. Vol. 111(1–2). P. 77–83.
16. Finnerup N.B., Otto M., McQuay H.J. et al. Algorithm for neuropathic pain treatment: an evidence based proposal // Pain. 2005. Vol. 118(3). P. 289–305.
17. Harden N., Cohen M. Unmet needs in the management of neuropathic pain // J. Pain Symptom Manage. 2003. Vol. 25(Suppl. 5).S.12–S17.
18. Tolle T., Xu X., Sadosky A.B. Painful diabetic neuropathy: a cross-sectional survey of health state impairment and treatment patterns // J. Diabetes Complications. 2006. Vol. 20(1). P. 26–33.
19. Tolle T., Dukes E., Sadosky A. Patient burden of trigeminal neuralgia: results from a cross-sectional survey of health state impairment and treatment patterns in six European countries // Pain Pract. 2006. Vol. 6(3). P. 153–160.
20. Seventer R., Sadosky A., Lucero M., Dukes E. A cross-sectional survey of health state impairment and treatment patterns in patients with postherpetic neuralgia // Age Ageing. 2006. Vol. 35(2). P. 132–137.
21. Argoff C.E. The coexistence of neuropathic pain, sleep, and psychiatric disorders: a novel treatment approach // Clin. J. Pain. 2007. Vol. 23(1). P. 15–22.
22. Tassone D.M., Boyce E., Guyer J., Nuzum D. Pregabalin: a novel gamma-aminobutyric acid analogue in the treatment of neuropathic pain, partial-onset seizures, and anxiety disorders // Clin. Ther. 2007. Vol. 29(1). P. 26–48.
23. Rosenstock J., Tuchman M., LaMoreaux L., Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controlled trial // Pain. 2004. Vol. 110 (3). P. 628–638.
24. Lesser H., Sharma U., LaMoreaux L., Poole R.M. Pregabalin relieves symptoms of painful diabetic neuropathy: a randomized controlled trialm // Neurol. 2004. Vol. 63(11). P. 2104–2110.
25. Richter R.W., Portenoy R., Sharma U. et al. Relief of painful diabetic peripheral neuropathy with pregabalin: a randomized, placebo-controlled trial // J. Pain. 2005. Vol. 6(4). P. 253–260.
26. Freynhagen R., Strojek K., Griesing T. et al. Efficacy of pregabalin in neuropathic pain evaluated in a 12-week, randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens // Pain. 2005. Vol. 115(3). P. 254–263.
27. Dworkin R.H., Corbin A.E., Young J.P. Jr et al. Pregabalin for the treatment of postherpetic neuralgia: a randomized, placebo-controlled trial // Neurol. 2003. Vol. 60(8). P. 1274–1283.
28. Sabatowski R., Galvez R., Cherry D.A. et al. 1008–045 Study Group Pregabalin reduces pain and improves sleep and mood disturbances in patients with post-herpetic neuralgia: results of a randomised, placebo-controlled clinical trial // Pain. 2004. Vol. 109(1–2). P. 26–35.
29. Seventer R., Feister H.A., Young J.P. Jr et al. Efficacy and tolerability of twice-daily pregabalin for treating pain and related sleep interference in postherpetic neuralgia: a 13-week, randomized trial // Curr. Med. Res. Opin. 2006. Vol. 22(2). P. 375–384.
30. Siddall P.J., Cousins M.J., Otte A. et al. Pregabalin in central neuropathic pain associated with spinal cord injury: a placebo-controlled trial // Neurol. 2006. Vol. 67(10). P. 1792–1800.
31. Saldaña M.T., Navarro A., Pérez C. et al. Health, non-health resources utilization and costs of treating refractory painful Radiculopathy in Primary Care Settings (PCS) under routine medical practice in Spain // Value Health. 2007.10:A464. Abstract.
32. Bouhassira D., Attal N., Fermanian J. et al. Development and validation of the Neuropathic Pain Symptom Inventory // Pain. 2004. Vol.108(3). P. 248–257.
33. Bouhassira D., Attal N., Alchaar H. et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4) // Pain. 2005. Vol.114(1–2). P. 29–36.
34. Perez C., Galvez R., Huelbes S. et al. Validity and reliability of the Spanish version of the DN4 (Douleur Neuropathique 4 questions) questionnaire for differential diagnosis of pain syndromes associated to a neuropathic or somatic component // Health Qual. Life Outcomes. 2007. Vol. 5. P. 66.
35. Melzack R. The short-form McGill Pain Questionnaire // Pain. 1987. Vol. 30(2). P. 191–197.
36. Sheehan D.V., Harnett-Sheehan K., Raj B.A. The measurement of disability // Int. Clin. Psychopharmacol. 1996. Vol. 11(Suppl. 3). P. 89–95.
37. Hays R.D., Stewart A.L. Sleep measures /Stewart A.L., Ware J.E., ed. Measuring functioning and well-being: The Medical Outcomes Study approach. – Durham, NC: Duke University Press; 1992. P. 235–259.
38. Rejas J., Ribera M.V., Ruiz M., Masrramon X. Psychometric properties of the MOS (Medical Outcomes Study) Sleep Scale in patients with neuropathic pain // Eur. J. Pain. 2007. Vol. 11(3). P. 329–340.
39. Zigmond A.S., Snaith R.P. The hospital anxiety and depression scale // Acta Psychiatr. Scand. 1983. Vol. 67(6). P. 361–370.
40. TheEuroQol Group EuroQol – a new facility for the measurement of health-related quality of life // Health Policy. 1990. Vol. 16(3). P. 199–208.
41. Kazis L.E., Anderson J.J., Meenan R.F. Effect sizes for interpreting changes in health status // Med. Care. 1989. Vol. 27. S.178–S189.
42. Brooks R. EuroQoL: the current state of play // Health. Policy. 1996. Vol. 37. P. 53.
43. Gore M., Dukes E., Rowbotham D.J. et al. Clinical characteristics and pain management among patients with painful peripheral neuropathic disorders in general practice settings // Eur. J. Pain. 2007. Vol. 11(6). P. 652–664.
44. Rodriguez M.J., Garcia A.J. A Registry of the Aetiology and Costs of Neuropathic Pain in Pain Clinics: Results of the Registry of Etiologies and Costs (REC) in Neuropathic Pain Disorders Study // Clin. Drug. Investig. 2007. Vol. 27(11). P. 771–782.
45. Watson C.P., Moulin D., Watt-Watson J. et al. Controlled-release oxycodone relieves neuropathic pain: a randomized controlled trial in painful diabetic neuropathy // Pain. 2003. Vol. 105 (1–2). P. 71–78.
46. Gimbel J.S., Richards P., Portenoy R.K. Controlled-release oxycodone for pain in diabetic neuropathy: a randomized controlled trial // Neurol. 2003. Vol. 60(6). P. 927–934.
47. Ritzwoller D.P., Crounse L., Shetterly S., Rublee D. The association of comorbidities, utilization and costs for patients identified with low back pain // BMC Musculoskelet. Disord. 2006. Vol. 7. P. 72.
48. Romano C.L., Romano D., Bonora C., Mineo G. Pregabalin, celecoxib, and their combination for treatment of chronic low-back pain // J. Orthop. Traumatol. 2009. Vol. 10 (4). P. 185–191.
49. Saldana M.T., Navarro A., Perez C. et al. Patient-reported-outcomes in subjects with painful lumbar or cervical radiculopathy treated with pregabalin: evidence from medical practice in primary care settings // Rheumatol. Int. 2010. Vol. 30 (8). P. 1005–1015.
50. Хабиров Ф.А., Есин Р.Г., Кочергина О.С. Прегабалин при лечении вертеброгенной корешковой боли // Consilium Medicum (прил. «Неврология»). 2011. № 15. С. 36–41.
Источник